Rouille brune
La rouille brune est causée par Puccinia triticina, un champignon basidiomycète[1] biotrophe[2]. Elle est observée dans toutes les régions du monde où le blé est cultivé. C’est donc la rouille la plus répandue parmi les trois principales rouilles (rouille brune, rouille jaune et rouille noire) capables d’infecter le froment. Elle est dispersée principalement par le vent (sur de longues et courtes distances) mais aussi parfois par la pluie. Sa multiplication au niveau de la culture est parfois très « explosive ». La rouille brune peut donc surprendre et causer des dégâts importants allant, en Europe, jusqu’à 30% de perte de rendement. La sévérité des épidémies dépend de la précocité de l’infection primaire, la résistance de la variété, de l’humidité et de la température.
Nom scientifique
Puccinia triticina Eriks.
Symptômes
Au niveau du champ :
L’épidémie de rouille brune se développe plutôt tardivement, vers la fin du mois de mai, sur les feuilles supérieures entre le stade dernière feuille étalée et le développement des grains. Des pustules peuvent cependant être observées bien plus tôt dans les champs, surtout si l’hiver est doux et le semis précoce. Après l’hiver, lorsque les températures redeviennent favorables (10°C-25°C), le pathogène reprend son cycle pouvant, à ce moment, détruire une partie importante des feuilles supérieures des froments. La rouille brune se répartit assez uniformément dans le champ, suite à une dissémination par le vent (Figure 1).
Sur feuille :
Les pustules de rouille brune recouvrent uniformément le limbe de la feuille (Figure 2). Elles sont réparties aléatoirement, sur la face supérieure de la feuille. Ces pustules brunes-orangées déchirent l’épiderme de la feuille et laissent échapper de la poudre brune composée de spores rondes et légères facilement transportées par le vent.
Distinguer rouille jaune et rouille brune :
La rouille brune se répartit de façon homogène dans le champ contaminé. Les feuilles infectées présentent des pustules brunes-orangées, plus grosses que celles de la rouille jaune (Figure 3), réparties aléatoirement sur la surface foliaire.
La rouille jaune, quant à elle, se répartit d’abord en foyers. Les feuilles contaminées présentent des pustules jaunes-oranges alignées sous forme de stries.
Epidémiologie
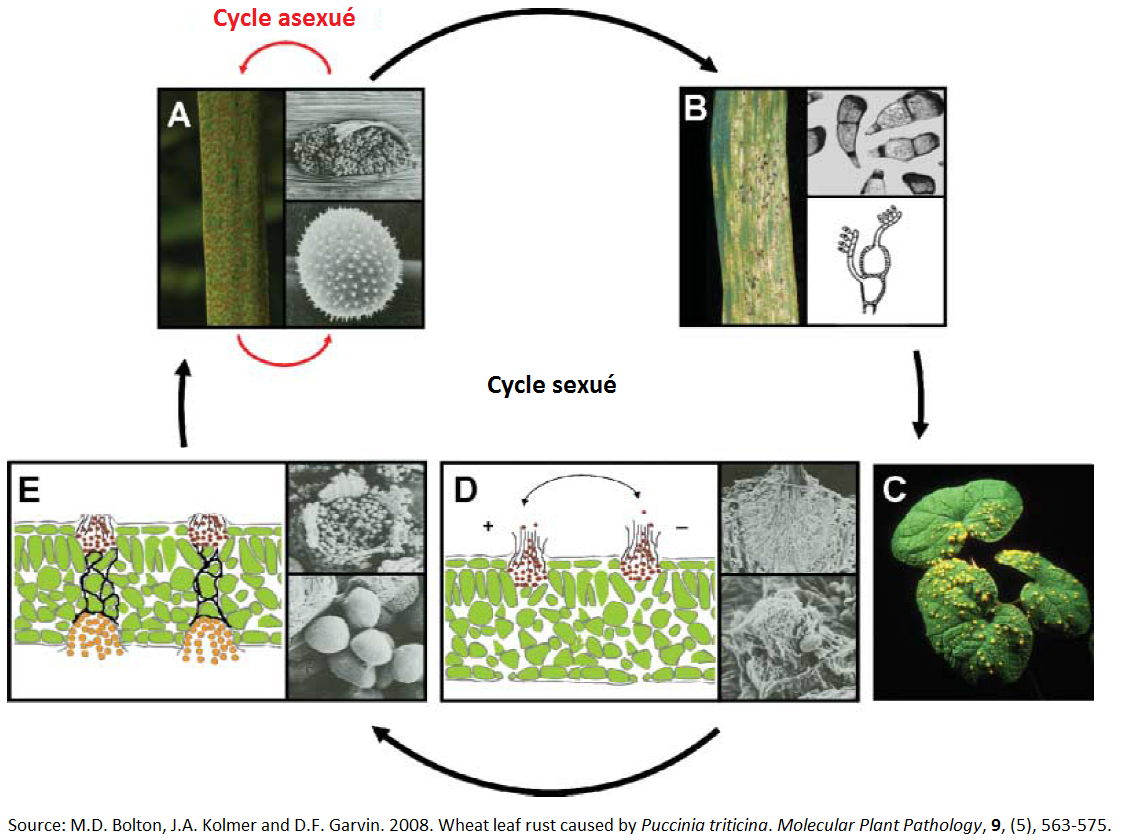
La rouille brune est un champignon hétéroïque[3], dont le cycle de vie complexe implique jusqu’à cinq sortes de spores différentes. La reproduction asexuée de Puccinia triticina se déroule sur son hôte primaire : principalement le blé. La reproduction sexuée se déroule, quant à elle, sur ses hôtes secondaires : le pigamon (Thalictrum speciosissimum) ou l’isopyre faux pigamon (Isopyrum fumaroides)[4]. En Wallonie, ces 2 plantes sont majoritairement présentes comme plantes ornementales c’est pourquoi seul le cycle asexuée joue un rôle important dans les épidémies de rouille brune. Le champignon est un biotrophe nécessitant un hôte vivant pour survivre et se multiplier. En Belgique, les cultures de blé sont généralement récoltées 2 à 3 mois avant que les nouvelles cultures emblavées émergent. Pendant cette période, la rouille brune survit sur les repousses des champs et sur certaines graminées. Ce phénomène est appelé, en anglais, « green bridge » qui peut être littéralement traduit par « pont vert ». En cas d’hiver peu rigoureux, la survie du champignon est très élevée. C’est cette source qui va constituer l’inoculum primaire majoritaire de la nouvelle culture et permettre l’infection de celle-ci dès la levée des semences. L’inoculum primaire d’un champ peut aussi provenir d’une source plus lointaine. En effet les spores de rouilles sont capables de voyager sur de longues distances, transportées par le vent.
Reproduction asexuée
En Belgique, bien que des pustules de rouille brune (urédosores) puissent apparaître tôt dans la saison, la phase épidémiologique de la maladie ne se déclenchera généralement pas avant la fin du mois de mai. A ce moment, les températures optimales (entre 15 et 25°) vont permettre au pathogène d’accomplir rapidement son cycle asexuée (entre 8 et 15 jours). Celui-ci est composé de 3 phases principales :
- L’infection de la feuille: Elle nécessite de l’humidité et des températures comprise entre 10-25°C.
- La période de latence: Elle est positivement corrélée à la température. Avec des températures moyennes de 15-20°C, elle dure entre 8 à 12 jours.
- La production de spores : Après ce temps de latence, les urédospores produites dans les urédosores vont pouvoir se disperser et infecter d’autres plantes du champ ou de champs plus lointains. La dispersion est fortement influencée par les turbulences au niveau de la canopée. Le vent joue donc un rôle primordial.
Reproduction sexuée
A la fin de la saison culturale, des pustules noires (téleutosores) de la même taille que les urédosores se forment à la surface des feuilles infectées. Chaque pustule contient des spores, appelées téleutospores. Ces dernières vont ensuite germer et produire des basidiospores de « mating-type[5] » + et –. Ces dernières sont capables d’infecter leurs hôtes alternatifs, Thalictrum et Isopyrum spp. Une fois sur l’hôte alternatif, les basidiospores germent et forment des pycnides sur la face supérieure des feuilles. Suivant le « mating-type » de la basidiospore d’origine, les pycnides produisent des pycniospores et des hyphes de « mating-type » + ou -. Une recombinaison a alors lieu lorsque les pycniospores et les hypes de « mating-type » opposés fusionnent. Les pycnides fécondées vont produire des écidies sur la face inférieure des feuilles de Thalictrum ou Isopyrum spp. Ces structures en forme de coupe contiennent des centaines d’écidiospores. Ces dernières sont capables d’infecter l’hôte primaire et d’ainsi recommencer un cycle asexué, par la production d’urédosores.
La rareté des hôtes alternatifs et leur résistance à l’infection font de cette reproduction sexuée un évènement extrêmement rare. Le cycle sexuel ne contribue donc pas à la dispersion de la maladie et n’est pas non plus une source de variation génétique dans nos régions.
Figure 4 : cycles de reproduction sexuée et asexuée de Puccinia triticina. A : cycle asexué avec production d’urédospores sur l’hôte primaire (blé). B : production de téleutospores et germination de celles-ci en basidiospores. C : symptômes de rouille brune sur l’hôte alternatif Thalictrum ou Isopyrum spp. D : germination des basidiospores de « mating type » + et – en pycnides produisant des pycnidiopsores et des hypes de « mating-type » + et – sur la face supérieure des feuilles. E : production d’écidies par les pycnides fécondées sur la face inférieure des feuilles. Ces structures vont produire des écidiospores qui pourront contanimer l’hôte primaire (blé). Source : M.D. Bolton, J.A. Kolmer and D.F. Garvin. 2008. Wheat leaf rust caused by Puccinia triticina. Molecular Plant Pathology, 9, (5), 563-575.
Situations à risque
Risque au niveau du champ
Le choix de la variété est un élément primordial lors de l’installation de la culture. Plus cette variété est sensible à la rouille brune et plus les pertes pourraient s’avérer importantes en cas d’épidémie. Il est donc très important de se renseigner sur les sensibilités des variétés aux maladies.
Comme la plupart des maladies en céréales, la rouille brune est favorisée par l’humidité. Il est donc important de n’exagérer ni la densité de semis, ni la fumure azotée.
Les repousses permettent au pathogène de survivre durant l’entre culture.
Risques liés au climat
La survie de la rouille brune à l’hiver est une des conditions nécessaires pour l’occurrence d’une forte pression durant la saison culturale. En effet, plus les champs sont infectés tôt dans la saison et plus le nombre de cycles pouvant avoir lieu dans la culture sera élevé. Les températures minimales pendant les mois les plus froids (Janvier à Mars) jouent un rôle primordial sur la pression en fin de saison. En effet, lorsque celles-ci sont très faibles, la présence du pathogène dans le champ s’en trouve diminuée. A partir du mois de mai, des températures comprises entre 10°C et 25°C ainsi qu’une humidité relative élevée (>60%) favorisent le cycle asexué. Les fortes précipitations peuvent avoir un effet positif sur la dispersion du pathogène mais ont tendance à vider les urédosores de leurs spores.
Méthodes de lutte
Leviers agronomiques
La meilleure méthode de lutte contre la rouille brune est l’utilisation de de variétés résistantes à cette maladie. C’est aussi la moins onéreuse.
Le travail du sol détruisant les repousses de froment empêche la survie de ce pathogène entre deux cultures successives. Cette méthode permet donc de diminuer l’inoculum primaire capable de contaminer les jeunes pousses de froment avant l’hiver.
Un semis tardif permet de diminuer l’exposition des jeunes plantules de blé à l’inoculum primaire avant l’hiver.
Lutte chimique
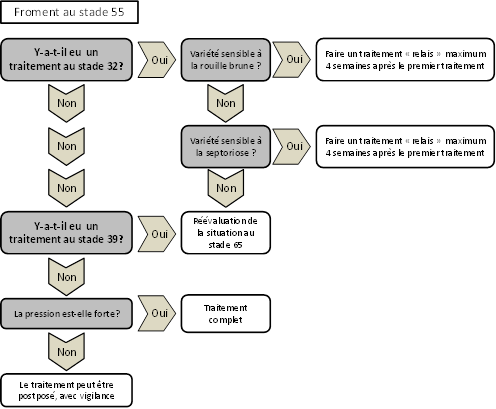
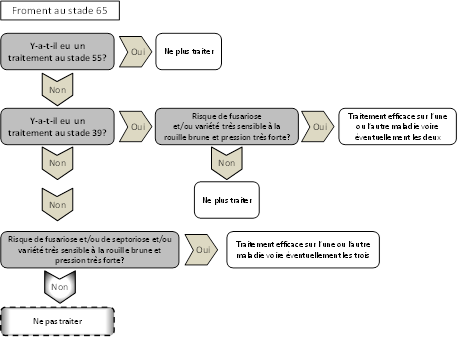
Sur les variétés sensibles, une protection fongicide doit impérativement être envisagée. Elle sera effectuée entre le stade dernière feuille complètement sortie (BBCH 39) et l’épiaison (BBCH 55). Des diagrammes décisionnels ont été établis ci-dessous afin de faciliter le choix du schéma de traitements.
Les strobilurines sont très efficaces sur rouille brune, de même que certaines triazoles (epoxiconazole, tebuconazole, cyproconazole et prothioconazole). Le mélange de ces deux familles offre des solutions très efficaces. L’ajout de SDHI à ces mélanges est une très bonne solution contre la rouille brune. En cas de traitement unique entre le stade dernière feuille complètement sortie et l’épiaison, le choix se portera idéalement sur un mélange de strobilurine, SDHI et triazole.
[1] Basidiomycètes : embranchement de champignons dont les spores sont formées à l’extrémité de cellules spécialisées, les « basides ». L’embranchement des Ascomycètes regroupe des champignons dont les spores se forment dans des « asques ».
[2] Biotrophe : champignon phytopathogène colonisant les tissus vivants.
[3] Hétéroïque : se dit des parasites animaux ou végétaux qui ne peuvent accomplir leur cycle reproductif complet qu'en vivant sur plusieurs hôtes successifs (Synonyme : polyxène).
[4] Certaines sources inversent les définitions d’hôtes « primaires » et « secondaires », et définissent l’hôte primaire comme celui sur lequel s’effectue la reproduction sexuée.
[5] Mating-type : chez les champignons, les structures reproductrices ne sont pas différenciables morphologiquement (isogamie), les mots « mâle » et « femelle » ne peuvent donc pas être utilisés. C’est pourquoi, le terme de « mating-type » est employé pour désigner les mécanismes moléculaires régissant la compatibilité entre les cellules reproductrices. Dans le cas de la rouille brune, les mating-types sont désignés par les symboles « + » et «-» et seul deux mating-types opposés peuvent se recombiner en une nouvelle structure. .